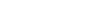Sistema de Notificación y Aprendizaje de Errores de Medicación
Etiquetado/envasado proclive a error
 Riesgo de confusión entre MicardisPlus® (telmisartán/ hidroclorotiazida) comprimidos con 40 mg/12,5 mg y 80 mg/12,5 mg
Riesgo de confusión entre MicardisPlus® (telmisartán/ hidroclorotiazida) comprimidos con 40 mg/12,5 mg y 80 mg/12,5 mg
- 26/02/2018

MicardisPlus® 40 mg/12,5 mg |

MicardisPlus® 80 mg/12,5 mg |
 “Decíamos ayer”: omisión en la administración de trimetoprima cuando se utiliza Soltrim® inyectable (sulfametoxazol + trimetoprima)
“Decíamos ayer”: omisión en la administración de trimetoprima cuando se utiliza Soltrim® inyectable (sulfametoxazol + trimetoprima)
- 15/02/2018
Soltrim®: vial con sulfametoxazol y ampolla con trimetoprima |
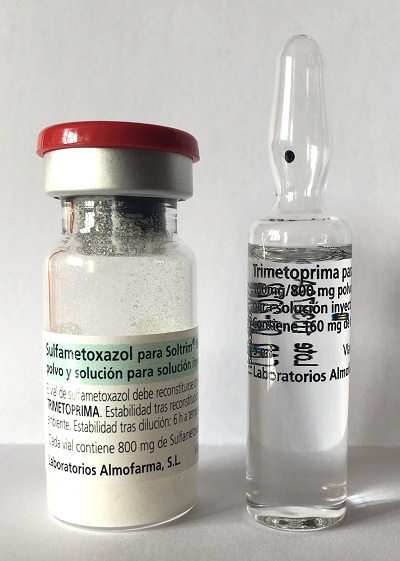
 Recordamos el riesgo de conservación incorrecta de los viales de Zerbaxa 1 g/ 0,5 g (ceftozolano/ tazobactam)
Recordamos el riesgo de conservación incorrecta de los viales de Zerbaxa 1 g/ 0,5 g (ceftozolano/ tazobactam)
- 29/01/2018
Zerbaxa 1 g/ 0,5 g (ceftozolano/ tazobactam) viales |
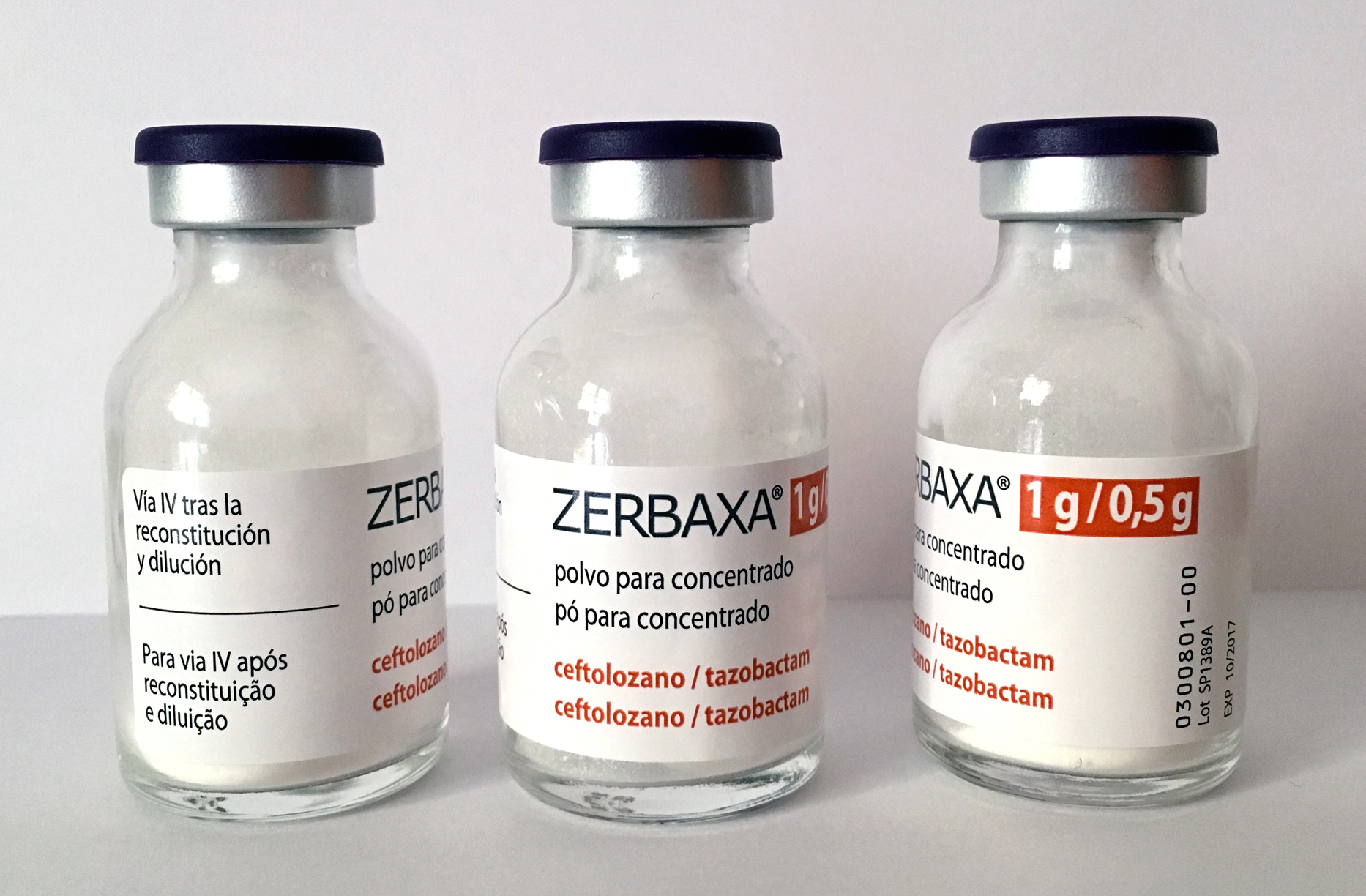
 “Decíamos ayer”: confusión entre las ampollas de Sandostatín® 0,05 mg (octreótido) y Sandimmun ® 50 mg (ciclosporina)
“Decíamos ayer”: confusión entre las ampollas de Sandostatín® 0,05 mg (octreótido) y Sandimmun ® 50 mg (ciclosporina)
- 09/01/2018
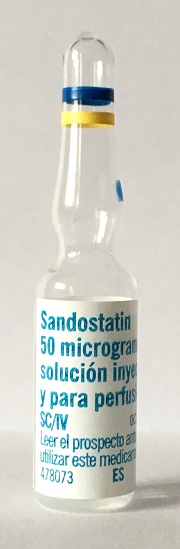
Sandostatín® 0,05 mg/1 mL |

Sandimmun® 50 mg/1 mL |
 Riesgo de confusión de los envases de Etopósido Tevagen® 100 mg/ 5 mL y Fludarabina Teva® 50 mg/ 2 mL
Riesgo de confusión de los envases de Etopósido Tevagen® 100 mg/ 5 mL y Fludarabina Teva® 50 mg/ 2 mL
- 18/11/2017
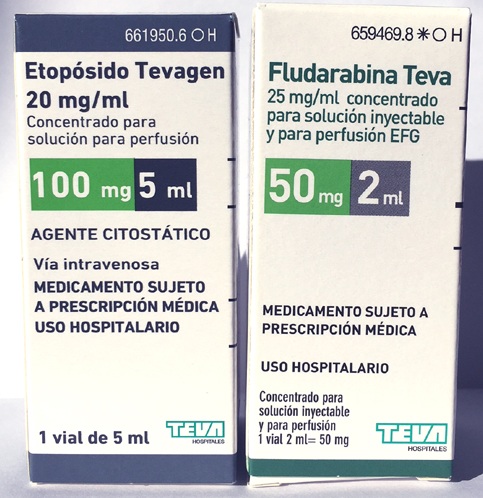
Etopósido Tevagen® 100 mg/ 5 mL y Fludarabina Teva® 50 mg/ 2 mL |
 Riesgo de confusión de los viales de CellCept® 500 mg (micofenolato mofetilo) y de Meropenem Aurovitas® 1000 mg
Riesgo de confusión de los viales de CellCept® 500 mg (micofenolato mofetilo) y de Meropenem Aurovitas® 1000 mg
- 10/11/2017
Se han recibido notificaciones informando del riesgo de confusión entre los viales de CellCept® 500 mg (micofenolato mofetilo) y los viales de Meropenem Aurovitas® 1000 mg. Aunque el diseño del etiquetado de estos medicamentos sea algo diferente, su tamaño similar y particularmente el tapón gris favorecen la similitud .
Para evitar posibles errores se recomienda adquirir estos medicamentos a diferentes proveedores, tratando de que su apariencia sea distinta.
|
CellCept® 500 mg (micofenolato mofetilo) y Meropenem Aurovitas® 1000 mg |
 Confusión entre las ampollas bebibles de Hidroferol® (calcifediol) 0,266 mg y las ampollas de Furosemida Gesfur® 20 mg
Confusión entre las ampollas bebibles de Hidroferol® (calcifediol) 0,266 mg y las ampollas de Furosemida Gesfur® 20 mg
- 28/10/2017
|
Hidroferol® 0,266 mg/1,5 mL y Furosemida Gesfur ® 20 mg/2 mL |
 Riesgo de errores de dosificación con Sprycel® (dasatinib) comprimidos recubiertos de 50 y 70 mg
Riesgo de errores de dosificación con Sprycel® (dasatinib) comprimidos recubiertos de 50 y 70 mg
- 22/06/2017
Los comprimidos recubiertos de Sprycel® (dasatinib) de 50 y 70 mg y otras presentaciones vienen acondicionados en blíster calendario cuyo etiquetado puede dar lugar a una interpretación equivocada de la composición cuantitativa de cada comprimido y, como consecuencia, a errores en la dosificación. Los blíster vienen etiquetados y troquelados de forma que aparecen dos alveolos consecutivos con sus correspondientes comprimidos para cada día de la semana (lunes-lunes, martes-martes y así hasta el domingo), de forma que parece indicar que el blíster completo de 14 comprimidos corresponde a una semana de tratamiento y que cada día de la semana el paciente tiene que tomar 2 comprimidos.
El error en la posología puede ocurrir cuando al paciente se le prescribe una dosis diaria que corresponda a 1 comprimido y, sin embargo, al ver este etiquetado piense tiene que tomar 2. Un caso notificado describe cómo a un paciente se le prescribió una dosis de 70 mg cada 24 horas y estuvo tomando durante varios días 2 comprimidos diarios.
Se recomienda informar a los pacientes de este hecho cuando se dispense. Además, el laboratorio fabricante debería modificar el etiquetado, de forma que cada comprimido estuviera acondicionado individualmente con indicación de su composición cuantitativa.

Sprycel® (dasatinib) comp 50 mg |
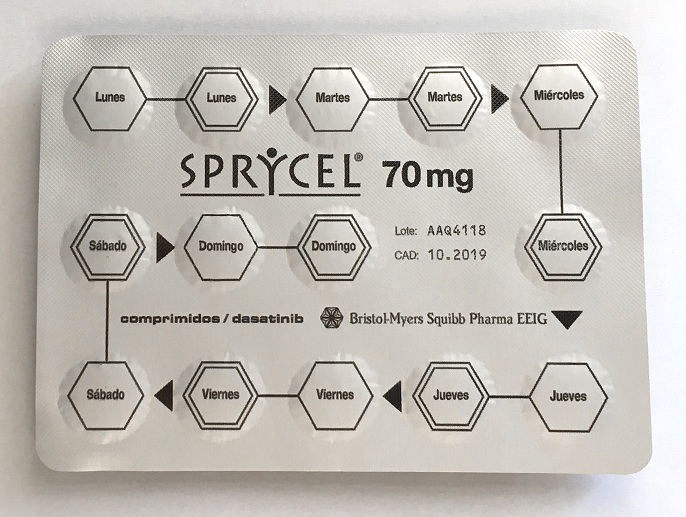
Sprycel® (dasatinib) comp 70 mg |


 anterior
anterior